Rehabilitationsergebnisse verbessern – Wie deine Physiotherapie erfolgreicher wird

In diesem Artikel wird aus Gründen der besseren Lesbarkeit das generische Maskulinum verwendet. Weibliche und anderweitige Geschlechteridentitäten werden dabei ausdrücklich mitgemeint, soweit es für die Aussage erforderlich ist.
Es ist immer unglücklich, wenn uns Schmerzen oder kleinere Verletzungen in unseren alltäglichen oder sportlichen Aktivitäten einschränken. Auch wenn das erstmal eine nervige Situation ist, wird es in den meisten Fällen von ganz alleine besser und wir sind bald wieder fit. Blöd wird es jedoch, wenn es langwierige Verletzungen oder Schmerzzustände sind und der Genesungsprozess länger dauert. In diesen Fällen benötigt es oftmals eine medizinische Diagnose, eine passende Versorgung und bei Beschwerden am Bewegungsapparat ist damit meistens eine physiotherapeutische Rehabilitation einhergehend.
Hier siehst du nun wichtige Faktoren, die den Erfolg deiner Physiotherapeutischen Rehabilitation mitbestimmen:
1. Dein Wissen über den Heilungsverlauf
“Die Erwartung ist die Mutter der Enttäuschung.”
Oft liegt eine große Diskrepanz zwischen dem, wie wir unseren Heilungsverlauf sehen, gegenüber dem, wie es tatsächlich ist. Wenn du aber darüber Bescheid weißt, wie lange es zumindest aus Sicht der verletzten Struktur dauert, kann es helfen, deine Genesungsdauer realistischer einzuordnen. Außerdem dient es als Orientierung, das Training und die Intensitäten innerhalb deiner Rehabilitation besser zu steuern.
Als sehr interessantes Beispiel würde ich dir gerne noch eine weitere biologische Heilungszeit vorstellen. Es geht um die Umwandlung einer Kreuzbandplastik in das neue Kreuzband. Um circa 6-12 Wochen nach OP erreicht das Transplantat wegen Umwandlungsprozessen den Tiefpunkt der Stabilität (Goradia et al., 2000). Nach einem Jahr scheint es vom mechanischen Standpunkt her dann ziemlich stark zu sein. Bis zur kompletten Ausreifung kann jedoch mehr als ein Jahr vergehen (Janssen & Scheffler, 2014; Scheffler et al., 2008; Claes et al., 2011). Und dies ist nur einer von vielen Gründen, warum man innerhalb der Kreuzband Rehabilitation nach Rekonstruktion keine voreiligen Comebacks starten sollte (Moretti et al., 2022; Hadley et al., 2022).

Hier siehst du eine tabellarische Darstellung der physiologischen Heilungszeiten einzelner Strukturen (Andrews et al., 2012).

2. Über Behandlungsmöglichkeiten bestmöglich aufklären lassen
Nachdem die ärztliche Diagnose gestellt wurde, folgt in der Regel eine Behandlungsempfehlung. Hier ist es wichtig, sich über die verschiedenen Behandlungsmöglichkeiten bestens aufklären zu lassen. Scheu dich nicht nachzufragen, wie es um die Wirksamkeit dieser Methoden steht. Wenn du das Gefühl hast, du bist nicht gut aufgeklärt, kann es Sinn machen, sich nach Zweitmeinungen umzusehen. Nachweislich wirksame Behandlungsmethoden von unnötigen Therapien zu unterscheiden wird dir helfen, die Effizienz deiner Rehabilitation zu steigern. Heißt im Klartext, du wirst voraussichtlich schneller wieder fit und ersparst dir unnötige Maßnahmen.
Hier zur Verdeutlichung zwei Beispiele:
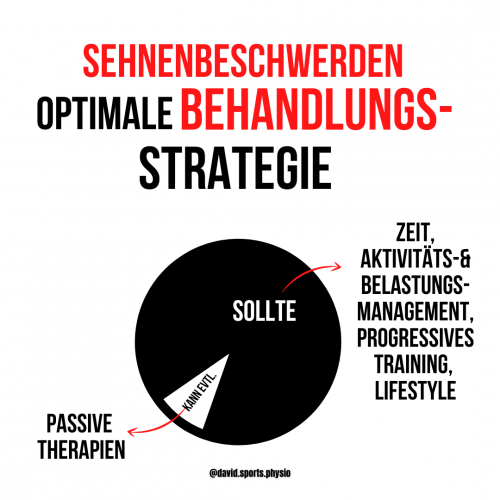
Bei Sehnenbeschwerden, zum Beispiel einer Tendinopathie der Achillessehne oder Patellasehne, sollten passive Therapien wie Ultraschall, Stoßwellen, Strom, Massagen, uvm. wohl eher im Rahmen eines gesamten Kontextes der auf Belastungsmanagement abzielt, angewendet werden (siehe Bild). Was allerdings nicht heißt, dass gewisse ausgelöste Wirkmechanismen, auch durch manuelle Therapie, nicht nützlich sein können. Erst vor kurzem ist eine sehr interessante Untersuchung von Radovanović & Kollegen (2022) erschienen, die schweres Krafttraining, moderates Krafttraining nach Alfredson (Alfredson et al., 2016) und Manuelle Therapie miteinander verglichen. Man stellte zwar fest, dass ausschließlich schweres Krafttraining die Robustheit (erhöhte Stiffness) der Sehne verbesserte, jedoch gab es keinen Unterschied zwischen den drei Gruppen hinsichtlich Schmerzen und Funktion.
Oftmals neigen Betroffene mit Sehnenbeschwerden dazu sich für längere Zeit auszuruhen. Jedoch ist diese Empfehlung von länger andauernder Entlastung der Sehne selten sinnvoll (Cardoso et al., 2019). Ein anderes Beispiel finden wir beim Thema Kreuzbandriss. Ist hier immer eine OP notwendig? Tatsächlich zeigen neueste Untersuchungen, dass es vergleichbar ähnlich gute Ergebnisse für konservative und operative Personen nach einem Kreuzbandriss geben kann. Nehmen wir zum Beispiel die Behauptung, dass eine Operation besser sei, da es vor zukünftiger Kniearthrose und Meniskusschäden schützt, konnte bisher nicht bestätigt werden. Daher sollte eine individuelle, patientenzentrierte Form der Versorgung vorgeschlagen werden, bei der die möglichen Behandlungsoptionen mit dem Patienten besprochen werden (Saueressig et al., 2022).
Die Wissenschaft über die Wirksamkeit der Therapien gibt es schon seit Jahrzehnten und sie kann uns helfen, die für uns vielversprechendsten Entscheidungen zum aktuellen Zeitpunkt zu treffen. Wichtig ist jedoch, dass es auch deine Entscheidung ist. Nur so kannst du deinem Genesungsweg positiv entgegensehen.
3. Hältst du die Treue?
Die “Therapietreue” (im Fachjargon Compliance oder Adhärenz) ist ein wichtiger Faktor, die das Ergebnis deiner Behandlung beeinflussen kann (Hayden et al., 2005).
Adhärenz wurde definiert als: „das Ausmaß, in dem das Verhalten einer Person den vereinbarten Empfehlungen eines Gesundheitsdienstleisters entspricht“ (WHO, 2003). Patienten, die sich an die Behandlung halten, können bessere Behandlungsergebnisse erzielen als Patienten, die sich nicht an die Behandlung halten (Vermeire et al., 2001; WHO, 2003). Klingt ja logisch, aber dennoch wird eine schlechte Adhärenz zur Therapie in vielen Bereichen des Gesundheitswesens festgestellt. Und eben auch in der Physiotherapie (Vasey, 1990; Friedrich et al., 1998; Campbell et al., 2001). Das Ausmaß der mangelnden Therapietreue bei physiotherapeutischen Behandlungen ist unklar. Vasey zeigte bereits in einer Studie im Jahre 1990, dass 14% der Patienten der Physiotherapie nicht zu ihren Folgeterminen erschienen. Eine andere Studie zeigt uns, dass die Nichtbefolgung der Behandlung und der Übungen bis zu 70% betragen könnte (Sluijs et al., 1993). Eine mangelnde Adhärenz hat dann eben nicht nur Auswirkungen auf die Wirksamkeit der Behandlung, sondern auch auf die Kosten des Gesundheitssystems. In der Physiotherapie ist das Konzept der Adhärenz vielschichtig (Kolt et al., 2007) und könnte sich auf die Teilnahme an Terminen, die Befolgung von Ratschlägen, die Durchführung der vorgeschriebenen Übungen, die Häufigkeit der Durchführung der vorgeschriebenen Übungen, die korrekte Ausführung der Übungen oder die Durchführung von mehr oder weniger als den Empfehlungen beziehen. Es wird angenommen, dass viele Faktoren, die mit dem Patienten, dem Therapeut und der Einrichtung zusammenhängen, die Therapietreue der Patienten beeinflussen (Miller et al., 1997).
Daraus können wir erkennen, dass unsere grundsätzliche Einstellung zur Therapie und deren Einhaltung von vielen Faktoren abhängig ist. Eine offene Kommunikation mit deinem Physiotherapeuten ist daher unersetzlich. So können Barrieren oder positive Elemente analysiert und besprochen werden. Oftmals ergeben sich daraus Ansatzpunkte, an denen man gemeinsam arbeiten kann. Mit großer Wahrscheinlichkeit wirkt sich dies schlussendlich begünstigend auf deine Resultate aus. Und wer mag keine besseren Resultate?

4. Erwartungshaltung über die Therapie & Schmerz
Deine gerade erwähnte Einstellung zur Therapie wird nicht nur durch eine offene Kommunikation beeinflusst, sondern durch viele weitere Faktoren. Darunter auch deine Erwartungshaltung. Chester und sein Forscherteam (2018) untersuchten in diesem Zusammenhang 811 Patienten mit Schulterschmerzen nach sechswöchiger, beziehungsweise sechs monatiger Physiotherapie. Es stellte sich heraus, dass eine höhere Erwartung an die eigene Genesung mit einem besseren Therapieergebnis in Verbindung stand. Interessant war auch, dass strukturelle Diagnosen hier kaum im Zusammenhang mit guten oder schlechten Therapieergebnissen identifiziert werden konnten. Auch die Art der Therapie (Bsp. Massage, manuelle Therapie, Trainingstherapie, …), die du persönlich bevorzugst und am effizientesten einschätzt, kann das Therapieergebnis beeinflussen (Kalauokalani et al., 2001). Es hat sich zum Beispiel gezeigt, dass Patienten mit chronischen unteren Rückenschmerzen, die mehr Schmerzlinderung von Massage im Vergleich zur Akupunktur erwarteten, bessere Ergebnisse darin hatten. Sehr bemerkenswert war, dass es sich umgekehrt genauso präsentierte.
Und Patienten, die allgemein starke Erwartungen an die Wirksamkeit der Therapien (egal welche) hatten, zeigten eine fünffach erhöhte Wahrscheinlichkeit zur Verbesserung ihrer Beschwerden im Vergleich zu jenen Patienten mit niedrigen Erwartungen.
Wir müssen deshalb anerkennen, dass unsere Erwartungen, die damit verbundenen Einstellungen, Überzeugungen und Vorlieben einen besonderen Einfluss auf die Ergebnisse der Therapie nehmen können (Foster, 2007; Preference Collaborative Review Group, 2008).
Und diese Faktoren der Genesung erstrecken sich nicht nur über Beschwerden am Bewegungsapparat. Positive Erwartungen sind im Allgemeinen mit besseren Genesungsverläufen verbunden (Mondloch et al., 2001). Jedoch scheint dies nicht immer für jeden und bei jeder Erkrankung oder Therapieform der Fall zu sein (Sherman et al., 2010).
Jedoch scheint die Forschung hier weitere Fortschritte machen zu können. In einer neuen Untersuchung von Müller-Schrader und Kollegen (2022) wurden die Schmerzintensität und die Erwartungen bezüglich der Behandlungseffekte von Injektionen bei 252 Patienten mit unteren Rückenschmerzen beobachtet. Auch hier wurde ersichtlich, dass die Erwartungen an die Behandlung eine wichtige Rolle für das Ergebnis nach lumbalen Injektionen spielen.
Schmidt et al. (2022) zeigte bei 134 Migränepatienten, dass eine positive Behandlungserwartung über eine medikamentöse Vorsorgebehandlung bei chronischen Migränepatienten (nicht episodischen) mit einer allgemein geringeren Anzahl von Kopfschmerz- und Migränetagen und einer stärkeren Verringerung der Kopfschmerztage im Verlauf der Behandlung verbunden waren.
Unser Verständnis von Schmerz hat sich zu einem Konzept entwickelt, das Empfindung, Emotion, Kognition und Motivation miteinander verbindet. Es ist nicht nur klar, dass Schmerzen sowohl mit als auch ohne körperliche Schädigung auftreten können, sondern auch, dass die subjektive Schmerzerfahrung durch die Wechselwirkungen zwischen Erwartungen und dem Niveau der eingehenden sensorischen Informationen von unseren Körperregionen tiefgreifend beeinflusst werden kann (Wager et al., 2004; Atlas und Wager, 2012). Es wurde festgestellt, dass alleine die Erwartung gegenüber Schmerzen zu Aktivierungsmustern im Gehirn führt, die jenen gleichen, die sensorische und emotionale Aspekte des Schmerzes modulieren (Porro et al., 2002). Was bedeutet, dass die Erwartung sich scheinbar wie eine Art Regler für mehr oder weniger Schmerzempfinden auswirken könnte. Demnach ist es nicht verwunderlich, dass weitere Studien dies bestätigen konnten. Veränderte Erwartungen konnten das Schmerzerlebnis, einschließlich der Intensität und der Abwendung gegen wahrgenommene Schmerzen verändern (Lorenz et al., 2005; Atlas und Wager, 2012). Während sich die Fähigkeit, Schmerzen vorherzusagen im gesunden Zustand als Lernverhalten erwiesen hat (Ploghaus et al., 2003), kann sie bei chronischen Schmerzpatienten zu Vermeidung und Angst führen (Corbetta und Shulman, 2002). Aus diesem Grund ist es wichtig unser Verständnis der Erwartung gegenüber und des Konflikts zu vertiefen, der entsteht, wenn die Erwartungen an den Schmerz nicht mit den körperlichen Reizen übereinstimmen. Auch hier steht und fällt es wohl mit der Kommunikation innerhalb der Therapie. Du merkst bestimmt so langsam, dass viele Dinge innerhalb der Physiotherapie beachtet werden sollten. Wenn du also Patient sein solltest, gehe sicher, Physiotherapeuten zu finden, die sich mit Kontextfaktoren wie auch der Erwartung auf das Schmerzerleben auskennen und dies mit dir in einfacher Sprache kommunizieren können.
5. Realistische Zielsetzungen
Normalerweise wirst du schon innerhalb der ersten Physiotherapiesitzung nach deiner Zielsetzung gefragt. Oft fällt in diesem Kontext auch der Wunsch „schmerzfrei“ zu werden und natürlich auch zu bleiben. Realistisch betrachtet ist dies ein Ding der Unmöglichkeit, denn Schmerzen sind evolutionistisch in uns verankert und fester Bestandteil des Organismus. Tatsächlich gibt es aber Menschen, die aufgrund von Genmutationen schmerzfrei sind (Weiss et al., 2011; Cox et al., 2006; Minett et al., 2012; Gangras et al., 2014). Wünschenswert ist dies jedoch nicht, da Schmerzen uns vor vielen Dingen schützen und daher als “Warnsystem” sehr nützlich sind.
Demnach macht es Sinn, dir folgende Frage zu stellen: “Was würde ich gerne wieder tun, was ich aufgrund meiner Schmerzen momentan nicht tun kann?” Dadurch erhältst du Gewissheit, welche Dinge für dich persönlich von Bedeutung sind. Für eine Hausfrau mag das ein einfacher Gang zum Supermarkt sein, um für die Familie sorgen zu können. Für einen Sportler die schnellstmögliche Rückkehr zu seiner Sportart und zu seinem alten Niveau, um Erfolge mit dem Team feiern zu können. Und genau auf Grundlage dieser bedeutenden Ziele sollte die Rehabilitation ausgerichtet werden, mit dir im Mittelpunkt. Dafür ist es günstig, innerhalb deiner Rehabilitation mit deinem Physiotherapeuten eine Art System zu entwickeln, welches dich Step by Step zurück zu der Aktivität bringt, die dir wichtig ist.
Praktisch ist, dass es bereits Systeme gibt, die sich als äußerst empfehlenswert und effizient erwiesen haben, wie zum Beispiel die 10-Task-Progression nach Kreuzbandrekonstruktion (Buckthorpe et al., 2020). Ein anderes Beispiel stellt uns Breda und Kollegen (2021) in der Rehabilitation bei einer Tendinopathie der Patellasehne vor. Aus diesen beiden Arbeiten geht hervor, dass man sich an Aufgaben, Übungen und funktionellen Werten orientiert, bevor eine Steigerung erfolgt. Auch bei häufig vorkommenden Muskelverletzungen, wie die der Hamstrings oder Adduktoren, gibt es bereits solche Systeme, die in der Rehabilitation empfehlenswert sind (Whiteley et al., o. D.; Acute Adductor Injuries Treatment Protocol, o. D.).
Das alles kann dir helfen, deine Zielsetzungen gemeinsam mit deinem Physiotherapeuten realistisch zu formulieren. Zusätzlich kannst du die Fortschritte innerhalb deines Genesungsprozesses besser einschätzen und lernst den Umgang mit dem Prozess. Und wir wissen ja bereits, wie bedeutsam Erwartungen in der Reha sein können.

6. Dynamischer Rehabilitationsplan
Allein die Tatsache, dass es bisher nur wenige qualitative Protokolle innerhalb der Rehabilitation von Verletzungen oder allgemein innerhalb der Physiotherapie gibt, zeigt uns, dass die Dauer der Rehabilitation sehr individuell sein kann.
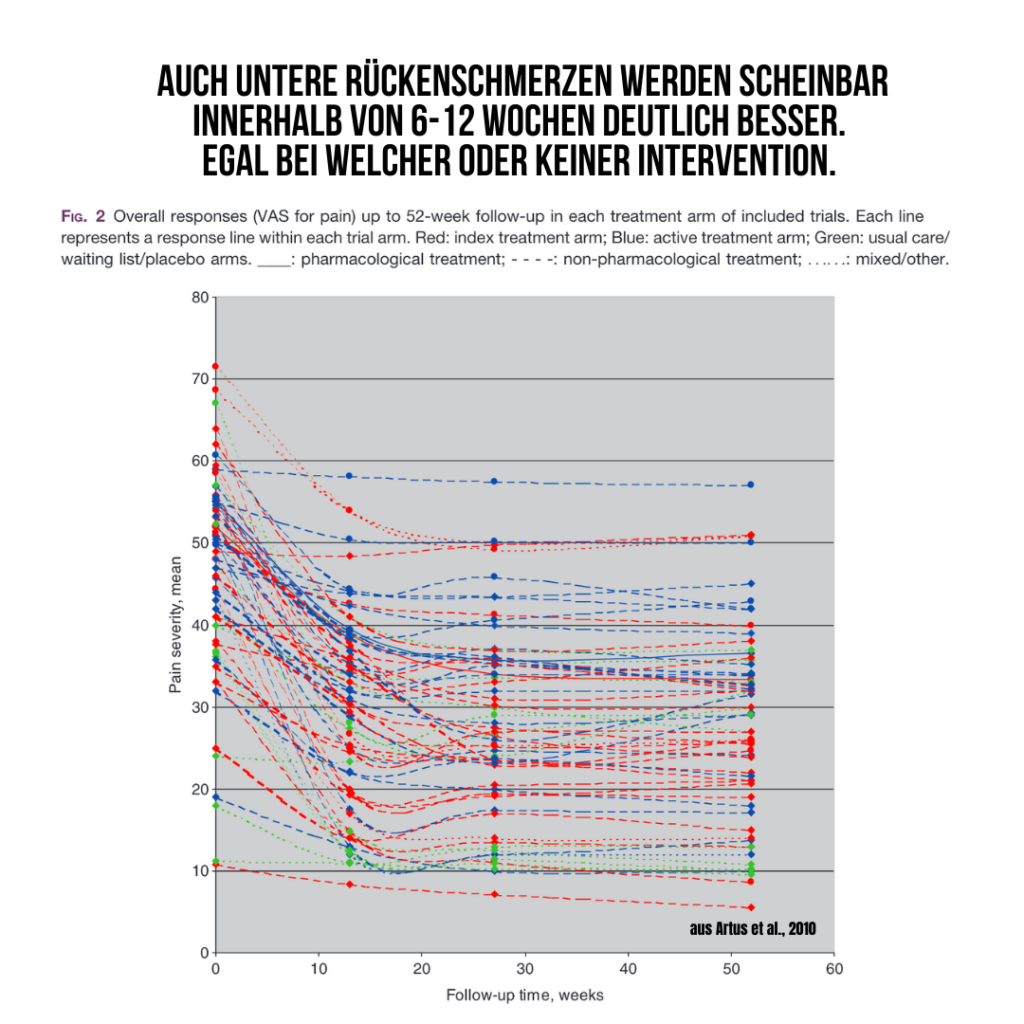
Die Planung der Rehabilitation sollte sich daher vor allem an dir und deinem persönlichen Tempo anpassen. Zum Beispiel kann es mal passieren, dass nicht alles so läuft, wie geplant und du wieder mehr Schmerzen oder Beschwerden bekommst. Das kann verschiedene Gründe haben, denn wie du aus den obigen (und folgenden) Abschnitten bereits weißt, gibt es viele Faktoren, die Einfluss auf die Rehabilitation nehmen. Mit diesen sogenannten “Flare-ups”, quasi das “Aufflammen der Symptome”, sollte dann adäquat umgegangen werden. Zum einen aus mentaler Sicht und zum anderen aus praktischer Sicht in Form von Anpassungen innerhalb deiner körperlichen Aktivität, sprich deiner Trainingsintensität. Du musst nicht jeden Tag oder jede Woche Fortschritte machen, das ist schlichtweg unrealistisch und würde nur dafür sorgen, dass du enttäuscht von der Therapie und dir selbst wärst. Rückschläge sind normal und manchmal sogar hilfreich, um uns beispielsweise genug Zeit für die vollständige Genesung zu geben. Bleib mutig und versuche Ruhe zu bewahren, selbst wenn es mal schwerer wird und du zu zweifeln beginnst. Das Überwinden dieser Täler lässt dich umso stärker werden. Und du wirst diese Täler überwinden. Es gibt etwas ziemlich Kraftvolles, was in jedem von uns steckt. Es nennt sich “Der natürliche Verlauf”. Wir heilen quasi ohne besondere Behandlung von ganz alleine über einen gewisse Zeit. Ein tolles Beispiel dafür ist die Arbeit von Artus & Kollegen (2010). Es wurden 118 Studien mit unterschiedlichen Behandlungen von akuten und chronischen Rückenschmerzen analysiert. Tatsächlich verbesserten sich alle innerhalb von 6 Wochen hinsichtlich der Schmerzen deutlich, egal welche Behandlung angewendet wurde. Sehr erstaunlich war, dass eben auch keine Behandlung diese Verbesserung der Schmerzintensität hervorrufen konnte. Servus Natürlicher Verlauf!
7. Weitere einflussnehmende Faktoren
Schlaf:
Reden wir direkt über einen meist unbedachten Einflussfaktor, der deine Rehabilitation positiv sowie negativ beeinflussen kann – Schlaf. Zu wenig Schlaf steht zum Beispiel in Zusammenhang mit einem niedrigeren Testosteron-Level (Leprout & van Cauter, 2005).
Die Bedeutsamkeit von Testosteron zeigt sich beim männlichen Sexualverhalten und der Fortpflanzung. Es wirkt sich aber auch auf die Muskelmasse, Muskelkraft, Adipositas (Fettleibigkeit), die Knochendichte sowie Vitalität und unser Wohlbefinden aus (Bremner, 2010). Des Weiteren zeigt uns Schlaf seine einflussnehmende Bedeutung, wenn es um das Immunsystem geht. Es besteht hier ein Zusammenhang mit der durchschnittlichen Schlafdauer. Es wurde festgestellt, dass Menschen mit 7 Stunden Schlaf oder weniger fast ein dreimal so hohes Risiko hatten eine Erkältung zu entwickeln (Cohen et al., 2009).

Wenn es um das Verletzungsrisiko geht, scheint auch hier Schlaf eine wichtige Rolle einzunehmen. Zum Beispiel wurde dies bei 160 Sportstudenten untersucht.
Bei jenen Sportlern, die im Durchschnitt <8 Stunden pro Nacht schliefen, war die Wahrscheinlichkeit einer Verletzung 1,7-mal höher als bei Sportlern, die ≥8 Stunden schliefen (Milewski et al., 2014). Eine Metaanalyse von Schrimpf et al. (2015) zeigte, dass eine verminderte Schlafqualität mit einer erhöhten Schmerzempfindlichkeit bei einer Reihe verschiedener Testmodalitäten hinsichtlich des Druckempfindes, Reizempfinden via Laser und Temperaturreizen verbunden war. Darüber hinaus wurde eine verminderte Schlafqualität auch mit einer niedrigeren mechanischen Schmerzschwelle in Verbindung gebracht (Schuh-Hofer et al., 2013; Chiu et al., 2005; Ağargün et al., 1999). So stellten Chiu et al. (2005) eine geringere Druckschmerzschwelle bei Teilnehmern fest, die nach eigenen Angaben schlecht schliefen, während Aǧargün et al. (1999) eine negative Korrelation zwischen Schmerzen und Schlafqualität feststellen, da schlechter Schlaf zu einer Zunahme der Schmerzempfindlichkeit bei Patienten mit Fibromyalgie führte. Diese Beispiele zeigen uns, dass wir Schmerzen intensiver und scheinbar auch früher verspüren, wenn unser Schlaf schlechter ist. Logischerweise spielt Schlaf auch bei unseren regenerativen Prozessen eine fundamentale Rolle. Schlafentzug (<7 h) erhöht die zirkulierenden Stresshormone, wie zum Beispiel Cortisol (Meerlo et al., 2008) und beeinflusst die Regeneration von Kohlenhydratspeichern negativ. (Morselli et al., 2010). Des Weiteren bringt er unseren Appetit aus dem Gleichgewicht und wirkt sich auf den Energieverbrauch aus (Knutson et al., 2007). Demzufolge hat zu wenig Schlaf Auswirkungen auf katabole Prozesse (Abbauprozesse) und den Anabolismus (Aufbauprozesse), was sich auf die Geschwindigkeit der Muskelreparatur auswirkt (Atrooz & Salim, 2020; Fullagar & Bartlett, 2016). Daher spielt Schlaf eine Schlüsselrolle bei der Optimierung der Erholung nach dem Training oder bei der Verringerung der Müdigkeit und Prozesse, die zu Ermüdung führen (De Pauw et al., 2013).
Ernährung:
Wie wir essen, hat Einfluss auf sämtliche Systeme unseres Körpers. Aus diversen Untersuchungen wissen wir heutzutage, dass die Optimierung der Nahrungsaufnahme sich auf chronische Schmerzen auswirkt (GBD 2017 Diet Collaborators, 2019; Naylor et al., 2013; Okifuji et al., 2015). Unsere Ernährung kann die Funktion des Nerven-, Immun- und Hormonsystems verbessern, was sich direkt auf das Schmerzerleben auswirkt. Gewichtsabnahme oder -erhaltung reduziert die Belastung der Gelenke und verringert entzündliche Prozesse. Die Nahrungsaufnahme und der Gewichtsstatus wirken sich auf das Risiko und/oder den Schweregrad anderer chronischer Krankheiten aus, die häufig gleichzeitig mit chronischen Schmerzen auftreten (z.B. Herz-Kreislauf-Erkrankungen, Diabetes und schlechte psychische Gesundheit, einschließlich Angst und Depressionen). Die IASP (Internationale Gesellschaft zur Erforschung des Schmerzes) hat auf Grundlage dessen Tipps für die Ernährung im Zusammenhang mit chronischen Schmerzen zusammengefasst. Darunter geht es um den Umgang und die Bedeutung verschiedener Nährstoffe für unsere Gesundheit.
Auch Verletzungen, die eine physiotherapeutische Rehabilitation nach sich ziehen, sollten wir dem Faktor Ernährung mehr Aufmerksamkeit schenken.
In den meisten Fällen führt eine Verletzung zu einer Immobilisierung oder Inaktivität. Unter diesen Umständen kann Muskelgewebe bereits nach 36 Stunden Inaktivität verloren gehen (Tipton et al., 2003). Nach 48 Stunden lassen sich Veränderungen der Genexpression im ganzen Körper messen. Und innerhalb von 5 Tagen Inaktivität würde man schließlich einen erheblichen Verlust an Muskelgewebe beobachten (Reich et al., 2013).
Die Aufrechterhaltung des kalorischen Gleichgewichts und die Deckung des erhöhten Energiebedarfs nach einer Verletzung sind daher entscheidend. Aufgrund verminderter körperlicher Aktivität nach einer Operation (z. B. vorderes Kreuzband, Rotatorenmanschette, Gelenkersatz, Fraktur) oder einer Verletzung besteht die erste Reaktion vieler Menschen darin, die Kalorienzufuhr zu reduzieren, um eine Gewichts- und Fettzunahme zu vermeiden. Eine negative Energiebilanz verschlimmert jedoch wahrscheinlich das Problem, indem sich die Wundheilung verlangsamt und eher den Muskelabbau begünstigt (Tipton, 2015). Eine negative Energiebilanz führt dann wahrscheinlich zu größeren Einbußen bei der Leistungsfähigkeit und verlängert die Zeit bis zurück zum Sport, was die Entwicklung eines Sportlers erheblich beeinträchtigen kann. Obwohl die Besorgnis über eine Gewichts- und Fettzunahme berechtigt ist, kann die Zusammensetzung der Nährstoffe in Kombination mit der Kalorienzufuhr dazu beitragen, Veränderungen der Körperzusammensetzung zu steuern (Arragon et al., 2017). Kurz gesagt: Es hat sich gezeigt, dass eine Ernährung mit weniger Kohlenhydraten (d.h. etwa 40%) oder einem Verhältnis von 2:1 zwischen Kohlenhydraten und Proteinen (z. B. 260 g Kohlenhydrate und 130 g Proteine) gewünschte Veränderungen der Körperzusammensetzung fördert (Layman, 2009; Layman et al., 2003; Weigle et al., 2005). Durch den Verzehr eines größeren Anteils an Eiweiß in Kombination mit komplexen Kohlenhydraten können wir voraussichtlich eine Gewichts- und Fettzunahme minimieren und gleichzeitig den Ernährungsbedarf für die Genesung decken.
Sprechen wir nun über Alkohol und den Einfluss auf die Rehabilitation. Alkohol beeinträchtigt die Muskelproteinsynthese und die Wundheilung, indem es die Entzündungsreaktion auf Verletzungen reduziert (Parr et al., 2014; Jung et al., 2011). Demnach verringert es auch die gewünschten Anpassungsprozesse und Verbesserungen des Leistungsniveaus infolge von Trainingseinheiten. Zudem kann Alkoholkonsum am Vortag zu einer erheblichen Verringerung der Leistung bei intensivem Training führen (Shaw et al., 2022). Klar ist auch, dass Alkohol unseren bereits kennengelernten Gamechanger Schlaf äußerst negativ beeinflusst (Zheng et al., 2021; Colrain et al., 2014). Umso wichtiger ist es deshalb, dass Physiotherapeuten und Trainer ihre Patienten und Sportler über die negativen Auswirkungen von Alkoholkonsum auf den gesamten Rehabilitationsprozess aufklären.
Proteine könnte man als kleinste Bausteine unseres Lebens betrachten. Sie sind Basis aller Lebensvorgänge. Sie bilden den Grundstein der Genetik, sind an chemischen Reaktionen im Körper beteiligt und liefern unserem Organismus Aminosäuren, aus denen Zellen und Gewebe, aber auch Antikörper zur Immunabwehr, Hormone und Enzyme aufgebaut sind. Der Bedarf an Aminosäuren ist gerade nach einer Verletzung deutlich erhöht. Die Aminosäurenaufnahme beschleunigt sich, um die Wundheilung, den Wiederaufbau des Gewebes und die Kontrolle des Blutzuckerspiegels zu unterstützen. (Evans et al., 2013; Demling, 2009) Wie oben bereits angedeutet, wird ohne Ernährungsunterstützung dieser Bedarf an Aminosäuren durch den Abbau der Skelettmuskulatur gedeckt (Demling, 2009). Abhängig von der Schwere der Verletzung, dem Grad der Immobilisierung und der Zeitspanne zwischen Verletzung und Operation kann dies zu einem erheblichen Verlust an Skelettmuskulatur führen. Der Verlust von Muskelmasse hat sich als ein unabhängiger Risikofaktor für eine längere Verweildauer im Krankenhaus herausgestellt. Eine Unterernährung, insbesondere von Eiweiß, verzögert die Wundheilung und erhöht das Risiko einer postoperativen Infektion (Evans et al., 2013; Demling, 2009). Verletzungsbedingter Stress erhöht den Proteinbedarf um etwa 80% gegenüber dem Ausgangswert. Für aktive Personen wird ein Bereich von 1,4 bis 2,0g/kg/Tag Protein empfohlen, um eine neutrale Eiweiß-Bilanz zu erhalten (Jäger et al., 2017).
Kohlenhydrate:
Kohlenhydrate sind eine wichtige Energiequelle während der Rehabilitation. Ihr Beitrag zur Genesung ist weitreichend und umfasst Funktionen innerhalb unseres Immun- und Hormonsystems und wirken an enzymatischen Prozessen mit (Demling, 2009). Sie haben auch eine proteinsparende Wirkung in katabolen Zuständen: Eine kohlenhydratreiche Ernährung reduzierte den Muskelproteinabbau stärker als eine fettreiche Ernährung (Hart et al., 2001). Während der Genesung von einer Verletzung sollten etwa 3 bis 5g/kg oder 55% der Gesamtkalorien in Form von komplexen Kohlenhydraten zugeführt werden (Thoams et al., 2016). Darunter beispielsweise Vollkorn, Obst, Gemüse und Milchprodukte. Der Bedarf an Kohlenhydraten steigt mit zunehmender körperlicher Aktivität. Nicht mehr als 60% der Gesamtkalorien sollten aus Kohlenhydraten stammen; ein höherer Verbrauch könnte zu einer Hyperglykämie führen und damit die Heilung und die Immunfunktion behindern (Demling, 2009). Einfache Kohlenhydrate in Form von verarbeitetem und raffiniertem Zucker sollten begrenzt werden. Komplexe Kohlenhydrate werden langsamer verdaut als einfache Kohlenhydrate, was zu einer nachhaltigeren Verfügbarkeit von Glukose führt. Komplexe Kohlenhydrate sind außerdem reich an Vitaminen, Mineralien und Ballaststoffen, die während der Rehabilitation wichtig sind.
Essentielle Fettsäuren:
Nach einer Verletzung wird eine Entzündungsreaktion ausgelöst, die für eine optimale Heilung von entscheidender Bedeutung ist (Tipton, 2015; Stechmiller, 2010). Eine lang anhaltende Entzündungsreaktion, wie sie häufig nach schweren Verletzungen oder Operationen auftritt, kann jedoch kontraproduktiv für die Heilung sein. Eine angemessene Ernährung nach einer Verletzung, insbesondere der Verzehr von essenziellen Fetten, kann dazu beitragen, das Ausmaß einer anhaltenden Entzündungsreaktion zu verringern (Lin et al., 1998). Fett ist eine wichtige Energiequelle für die Wundheilung und die Zellproduktion. Mehrfach ungesättigte und einfach ungesättigte Fettsäuren werden für die Herstellung von Zellmembranen verwendet, während gesättigte Fettsäuren häufig als Brennstoff verwendet werden. Mehrfach ungesättigte Fette enthalten zwei essenzielle Fettsäuren, α-Linolensäure (ω-3-Fettsäure) und Linolsäure (ω-6-Fettsäure), die über die Nahrung aufgenommen werden müssen. Während der Genesung ist eine Ernährung mit einem hohen Gehalt an einfach ungesättigten Fettsäuren und mehrfach ungesättigten ω-3-Fettsäuren ideal (Calder, 2013; Galland, 2010). Etwa 20-25% der Kalorien sollten aus Fett stammen: 0,8 bis 2g/kg/Tag (aufgrund der Kaloriendichte) (Demmling, 2009). Die empfohlene tägliche Zufuhr beträgt 2g ω-3-Fettsäuren und 10g ω-6-Fettsäuren (Agostoni et al., 2012). Übliche Nahrungsquellen für ω-3-Fettsäuren sind Avocado, Olivenöl, Fisch, Flachs, Nüsse und Samen. Während des Erholungsprozesses sollten ω-6-Fettsäuren, die in verarbeitetem Fleisch, gebratenen und fettigen Lebensmitteln sowie Pflanzenölen enthalten sind, aufgrund ihrer entzündungsfördernden Eigenschaften eingeschränkt werden.

Alles in allem müssen wir anerkennen, dass die Ernährung eine wesentliche Rolle bei der Genesung und Rehabilitation von Verletzungen einnimmt. Eine Fülle von Daten unterstützt praktische Ernährungsempfehlungen zur Verringerung chirurgischer Komplikationen, zur Minimierung des Muskelabbaus während der Ruhigstellung und zur Maximierung der Performance bei der Rückkehr zum Sport. Zuallererst sollte der individuelle Kalorienbedarf ermittelt werden, um sicherzustellen, dass der Energiebedarf gedeckt wird. Eine höhere Proteinzufuhr, wobei besonders auf eine gleichmäßige Verteilung über den Tag zu achten ist, wird den Verlust an Muskelmasse und Kraft während der Ruhigstellung minimieren. Nahrungsergänzungsmittel können hilfreich sein, wenn es darum geht, bei geringem Appetit die richtige Kalorienzufuhr und das richtige Timing zu finden. Mit einem guten Ernährungsplan können die Ergebnisse einer optimalen Physiotherapie und Rehabilitation verbessert und möglicherweise beschleunigt werden, so dass sich die Patienten schneller erholen und früher wieder aktiv sein können.
Stress:
Evolutionär betrachtet beschreibt Stress eine natürliche Reaktion auf Bedrohungssituationen. Wir schütten Stresshormone, wie zum Beispiel Adrenalin aus, die kurzfristig die körperliche Leistungsfähigkeit erhöhen, um auf Gefahren reagieren zu können. Diese “fight or flight” Reaktion (Kampf oder Flucht) war vor allem früher überlebensnotwendig. In unserem modernen Alltagsleben wird diese “Kampf oder Flucht” Reaktion jedoch meistens nicht, wie früher, durch gefährliche Tiere ausgelöst. Stattdessen schütten wir diese Stresshormone oftmals bei für uns alltäglichen „stressigen“ Situationen aus, wie beispielsweise das zu lange Warten an einer roten Ampel, Zeitdruck auf der Arbeit oder beim Schauen von Netflix.
Bekannt ist, dass Stress auf Dauer auch ungesunde Auswirkungen auf unsere mentale, systemische und körperliche Gesundheit hat. Dementsprechend kann Stress auch in der Rehabilitation negative Konsequenzen haben. In den folgenden Beispielen geht es vor allem um Studien, die Stress im Zusammenhang mit Verzögerungen der Wundheilung ( Haut & Schleimhaut) untersuchten. Zum Beispiel wurde nach chirurgischen Eingriffen größere Angst oder Stress vor der Operation mit schlechteren Ergebnissen der Heilung in Verbindung gebracht. Darunter längere Krankenhausaufenthalte, mehr postoperative Komplikationen und höhere Raten von erneuten Aufenthalten im Krankenhaus (Kiecolt-Glaser et al., 1998; Rosenberger et al., 2006).

Eine andere Untersuchung über 53 Erwachsenen mit chronischen Unterschenkelwunden (offene Beine) stellte fest, dass psychologische Faktoren die Heilung beeinflusst. Bei Patienten, die am stärksten unter Depressionen und Angstzuständen litten, war die Wahrscheinlichkeit der verzögerten Heilung viermal so hoch wie bei Personen, die über weniger Stress berichteten (Cole-King & Harding, 2001). Psychische Belastung scheint also die Genesung von medizinischen Eingriffen und die Heilung chronischer Wunden beeinflussen zu können. Stress kann auch bei jüngeren Menschen Auswirkungen auf die Heilung nehmen, die weniger starkem Stress ausgesetzt waren. Bei 24 jungen Männern wurde eine Wunde am Unterarm (nach 4 Millimeter Stanzbiopsie) 21 Tage lang beobachtet. In dieser Studie wurde die Wundheilung mit Hilfe der Ultraschall-Biomikroskopie beurteilt. Das Stressniveau wurde mit einem Fragebogen zur Selbsteinschätzung gemessen. Höherer empfundener Stress am Tag der Biopsie war mit einer langsameren Wundheilung verbunden (Ebrecht et al., 2004). Zwischen dem wahrgenommenen Stress und dem Heilungsfortschritt im Zeitraum vom 7. und 21. Tag nach der Biopsie wurde ein deutlicher Zusammenhang festgestellt. Auch Schmerz, ein physischer und psychischer Stressfaktor, kann unsere Heilung beeinflussen. Adipösen Frauen wurde vor einer elektiven Magenbypass-Operation eine zwei Millimeter dicke Wunde auf der Rückseite des Oberarms gelegt. Größere akute Schmerzen unmittelbar nach der Operation und anhaltende Schmerzen in den 4 Wochen nach der Operation waren mit einer langsameren Heilung der experimentellen Wunde verbunden (McGuire et al., 2006). Schmerzen erzeugen psychischen Stress und können, wenn sie durch das Vorhandensein anderer Stressfaktoren verstärkt werden, ein erhöhtes Risiko für eine verzögerte Wundheilung darstellen (Graham et al., 2006).
Wie kutane Wunden (Haut) reagieren auch Schleimhautwunden auf psychischen Stress, wie eine Studie mit akademischem Prüfungsstress zeigt. Im Rahmen eines Studiendesigns wurde bei 11 Zahnmedizinstudenten während der Sommerferien und erneut 3 Tage vor einer großen Prüfung eine Biopsie am harten Gaumen durchgeführt. Schleimhautwunden, die vor der Prüfung angelegt wurden, heilten im Durchschnitt 40% langsamer als identische Wunden, die während der Sommerferien angelegt wurden. Wichtig ist, dass die Unterschiede in der Heilungsrate sehr konstant waren: Kein Student heilte während der Prüfungen so schnell wie in den Ferien (Marucha et al., 1998). Die Auswirkungen negativer Emotionen auf die Wundheilung der Schleimhäute wurden in einer größeren Studie wiederholt. Bei 193 gesunden Studenten, denen eine 3,5 mm große Wunde am harten Gaumen zugefügt wurde, war die Wahrscheinlichkeit, dass sie als langsam heilend eingestuft wurden, bei Personen mit starken depressiven Symptomen fast 3,6 Mal höher als bei weniger dysphorischen Studenten (Bosch et al., 2007). Es gibt auch umgekehrte Studien, die die Heilungsergebnisse durch eine Verringerung des psychischen Stresses verbessern. Diese liefern weitere Belege für den Einfluss psychologischer und verhaltensbezogener Faktoren auf die Wundheilung. Metaanalysen klinischer Studien zeigen, dass verhaltenstherapeutische Maßnahmen zur Stressbewältigung vor der Operation mit besseren postoperativen Ergebnissen, einschließlich weniger medizinischer Komplikationen und kürzerer Krankenhausaufenthalte, in Verbindung gebracht wurden (Johnston & Vögele, 1993; Montgomery et al., 2002).
Ein weiterer Faktor kann auch körperliche Bewegung sein. Sport kann nicht nur die Herz-Kreislauf-Funktion verbessern, sondern auch die psychische Belastung verringern (Emery & Blumenthal, 1991). Ältere Erwachsene wurden nach dem Zufallsprinzip in eine Trainingsgruppe (dreimal pro Woche eine Stunde Aerobic-Training) oder eine Kontrollgruppe ohne Intervention eingeteilt. Einen Monat nach Beginn der Intervention wurde den Teilnehmern eine 3,5 mm große Stanzbiopsie auf der Rückseite des nicht dominanten Oberarms entnommen. Bei den älteren Erwachsenen, die Sport trieben, heilten die Wunden schneller als bei der Kontrollgruppe (Emery et al., 2005).
Die Biologie dahinter sieht im Grunde genommen so aus: Psychologischer Stress führt zur Aktivierung der Hypothalamus-Hypophysen-Nebennierenrinden-Achse und der Sympathikus-Nebennierenrinden-Achse (Padgett & Glaser, 2003). Eine verstärkte Produktion von Glukokortikoiden und Katecholaminen kann mehrere Komponenten des Heilungsprozesses direkt beeinflussen. Zahlreiche Belege aus Tier- und Humanstudien weisen darauf hin, dass physiologische Stressreaktionen die anfängliche Entzündungsphase der Wundheilung verzögern können (Glaser & Kiecolt-Glaser, 2005). Diese Abbildung zeigt eine schematische Darstellung der verhaltensbezogenen und physiologischen Pfade, die Stress und Wundheilung miteinander verbinden.
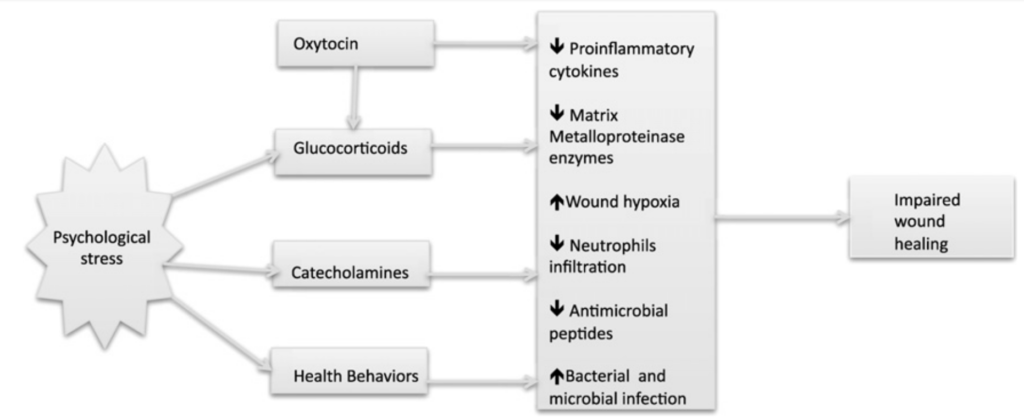
Gouin & Kiecolt-Glaser, 2011
Neben der direkten Beeinflussung der physiologischen Reaktionen auf Hautschäden kann Stress auch indirekt die Wundheilung beeinflussen, indem er gesundheitsschädigende Verhaltensweisen fördert. Personen, die ein höheres Maß an Stress erleben, konsumieren mit größerer Wahrscheinlichkeit mehr Alkohol und Tabak, treiben weniger Sport, leiden unter Schlafstörungen und ernähren sich schlechter als Personen, die unter weniger Stress leiden (Steptoe et al., 1996; Vitaliano et al., 2002). Diese negativen Verhaltensweisen können die nachteiligen Auswirkungen von Stress auf physiologische Heilungsprozesse noch verstärken (Kiecolt-Glaser et al., 1998). Starker Alkoholkonsum wurde mit einer Verzögerung der Zellmigration und der Kollagenablagerung an der Wundstelle in Verbindung gebracht, was wiederum den Heilungsprozess behindern kann (Benveniste & Thut, 1981). Auch das Rauchen wurde mit einer verlangsamten Heilung von natürlichen und chirurgischen Wunden in Verbindung gebracht (Silverstein, 1992). Schlafstörungen verzögern die Erholung der Hautbarriere nach dem Abziehen von Klebebändern und vermindern die Produktion von Wachstumshormonen (Altemus et al., 2001; Veldhuis & Iranmanesh, 1996). Ein Mangel an regelmäßiger körperlicher Betätigung kann die Wundheilungszeit verlangsamen (Keylock et al., 2008). Außerdem kann wie bereits im oberen Abschnitt erwähnt eine unzureichende Aufnahme von Glukose, mehrfach ungesättigten Fettsäuren, Proteinen und bestimmten Vitaminen den Heilungsprozess behindern (Russell, 2001; Posthauer, 2006; McDaniel et al., 2008).
Wie wir erkennen können, interagieren viele größere Faktoren miteinander innerhalb des Gesamtkontextes der betroffenen Person. Das Besprechen dieser fundamentalen Dinge kann einen großen Unterschied für die Genesungszeit innerhalb der Physiotherapie machen. Physiotherapeuten sollten sich daher darüber im Klaren sein, dass vieles mehr eine Rolle in der Rehabilitation spielt und einzelne Kontextfaktoren quasi wie Zahnrädchen ineinander greifen können. Im positiven als auch im negativen Sinne.
8. Den Erfolg messbar machen
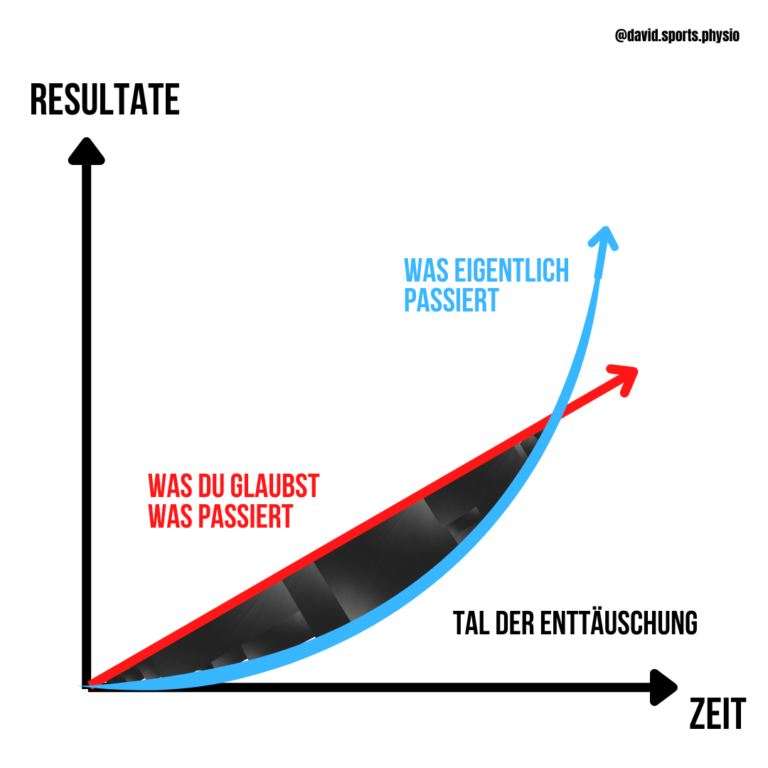
Schon mal vom Tal der Enttäuschung gehört? Wie du an der Darstellung erkennen kannst, geht es um die überzogenen Erwartungen, die man an sich selbst auferlegt, aber innerhalb des Rehaprozess nicht erfüllen kann. Solange dies der Fall ist, befinden wir uns im “Tal der Enttäuschung“. Gerade hier ist es besonders wichtig, die kleinen Steps zu erkennen und wertzuschätzen. Dies funktioniert durch das Messen dieser kleinen Schritte. Hierfür legt uns die Forschung eine Vielzahl an aussagekräftigen Messinstrumente dar. Diese sollten logischerweise immer mit Vorsicht und innerhalb des Gesamtkontext interpretiert werden.

Das einfachste Messinstrumente, dass sich die meisten Physiotherapeuten zu Nutze machen, ist wohl die numerische Analogskala. Sie zeigt uns den momentan subjektiv empfundenen Schmerz des Patienten. Eine Momentaufnahme. Jedoch kann uns diese Momentaufnahme, wenn sie oft genug wiederholt wird, eine Tendenz der Schmerzintensität und deren Entwicklung erkennen lassen. Genauso können funktionelle Werte wie Kraft oder Beweglichkeit gemessen werden. Jedes Kilo und jedes Grad kann und sollte regelmäßig aufgenommen werden. Zum einen motivierend, zum anderen realitätsgetreu und größtenteils objektiv. Darüber hinaus gibt es eine Menge an Fragebögen, die zu Beginn und in festgelegten Abständen ausgefüllt werden können. Diese ergeben gewisse Scores, die innerhalb der Rehabilitation für das Erreichen besonderer Meilensteine und das Fortschreiten in das nächste anspruchsvollere Level, wie beispielsweise die Rückkehr zum Sport, mitentscheiden können. Diese sogenannte Outcome-Messung ist das Ergebnis eines Tests, der auch dazu dient, die Wirksamkeit der Behandlung zu bestimmen. Mit dem Übergang zur evidenzbasierten Praxis (EBP) in den Gesundheitswissenschaften (Sacket et al., 1996) sind objektive Messungen wichtig, um eine glaubwürdige und zuverlässige Begründung für die Behandlung zu liefern. Das Instrument sollte auch für den Therapeuten leicht anwendbar und für den Patienten angenehm sein.
9. Fazit
Die Physiotherapie befindet sich stetig im Wandel. Grundlage dafür stellen die wissenschaftliche Forschung und daraus resultierende Herausforderungen der Integration dieser Ergebnisse in die Praxis dar. Stetiges Lernen, Anpassen und ein skeptischer Umgang mit den eigenen Ansichten sollten unter anderem fundamentale Charaktereigenschaften eines und einer qualifizierten Physiotherapeut*in sein. So kann mit einer guten Mischung von kommunikativen Fähigkeiten und Empathie zu einem Maximum gewährleistet werden, dass die obigen Punkte innerhalb der bestmöglichen Versorgung für dich als Patient berücksichtigt werden. Vielen Dank fürs Lesen und das Interesse!
Wenn du Hilfe in der Rehabilitation nach einer Verletzung oder für dich passende Physiotherapie suchst, kontaktiere uns einfach hier.
Mit den besten Grüßen
Dein DK Sports & Physio Team aus der Karlsruher Oststadt

Unsere weiteren Blog-Artikel


Was manuelle Lymphdrainage (nicht) kann

Gelenkgeräusche – muss man sich Gedanken machen?
Seitlicher Hüftschmerz Update und Deep-Dive

Faszinierend oder fast nicht belegt – Der Faszien-Hype kritisch betrachtet

Von Eisbädern bis Foam Rolling: Was hilft wirklich gegen Muskelkater?

Kreuzbandrehabilitation – Wie lange brauche ich die Unterarmgehstützen?
Wie schief bin ich eigentlich und ist das schlimm?
Quellenangaben:
Md, J. A. R., Atc, E. G. H. L. & Dpt, P. K. W. E. (2012). Physical Rehabilitation of the Injured Athlete: Expert Consult – Online and Print (4. Aufl.). Saunders.
Goradia VK, Rochat MC, Kida M, Grana WA. Natural History of a Hamstring Tendon Autograft Used for Anterior Cruciate Ligament Reconstruction in a Sheep Model. The American Journal of Sports Medicine. 2000;28(1):40-46. doi:10.1177/03635465000280011901
Janssen, R. P., & Scheffler, S. U. (2014). Intra-articular remodelling of hamstring tendon grafts after anterior cruciate ligament reconstruction. Knee surgery, sports traumatology, arthroscopy : official journal of the ESSKA, 22(9), 2102–2108. https://doi.org/10.1007/s00167-013-2634-5Scheffler, S. U., Unterhauser, F. N., & Weiler, A. (2008). Graft remodeling and ligamentization after cruciate ligament reconstruction. Knee surgery, sports traumatology, arthroscopy : official journal of the ESSKA, 16(9), 834–842. https://doi.org/10.1007/s00167-008-0560-8
Claes, S., Verdonk, P., Forsyth, R., & Bellemans, J. (2011). The „ligamentization“ process in anterior cruciate ligament reconstruction: what happens to the human graft? A systematic review of the literature. The American journal of sports medicine, 39(11), 2476–2483. https://doi.org/10.1177/0363546511402662
Moretti, L., Bizzoca, D., Cassano, G. D., Caringella, N., Delmedico, M., & Moretti, B. (2022). Graft Intra-Articular Remodeling and Bone Incorporation in ACL Reconstruction: The State of the Art and Clinical Implications. Journal of clinical medicine, 11(22), 6704. https://doi.org/10.3390/jcm11226704
Hadley, C. J., Rao, S., Tjoumakaris, F. P., Ciccotti, M. G., Dodson, C. C., Marchetto, P. A., Hammoud, S., Cohen, S. B., & Freedman, K. B. (2022). Safer Return to Play After Anterior Cruciate Ligament Reconstruction: Evaluation of a Return-to-Play Checklist. Orthopaedic journal of sports medicine, 10(4), 23259671221090412. https://doi.org/10.1177/23259671221090412
Radovanović, G., Bohm, S., Peper, K.K. et al. Evidence-Based High-Loading Tendon Exercise for 12 Weeks Leads to Increased Tendon Stiffness and Cross-Sectional Area in Achilles Tendinopathy: A Controlled Clinical Trial. Sports Med – Open 8, 149 (2022). https://doi.org/10.1186/s40798-022-00545-5
Alfredson H, Pietilä T, Jonsson P, Lorentzon R. Heavy-Load Eccentric Calf Muscle Training For the Treatment of Chronic Achilles Tendinosis. The American Journal of Sports Medicine. 1998;26(3):360-366. doi:10.1177/03635465980260030301
Cardoso, T. B., Pizzari, T., Kinsella, R., Hope, D., & Cook, J. L. (2019). Current trends in tendinopathy management. Best practice & research. Clinical rheumatology, 33(1), 122–140. https://doi.org/10.1016/j.berh.2019.02.001
Saueressig T, Braun T, Steglich N, et al Primary surgery versus primary rehabilitation for treating anterior cruciate ligament injuries: a living systematic review and meta-analysis, British Journal of Sports Medicine Published Online First: 29 August 2022. http://dx.doi.org/10.1136/bjsports-2021-105359
Hayden, J. A., van Tulder, M. W., & Tomlinson, G. (2005). Systematic review: strategies for using exercise therapy to improve outcomes in chronic low back pain. Annals of internal medicine, 142(9), 776–785. https://doi.org/10.7326/0003-4819-142-9-200505030-00014
Vermeire, E., Hearnshaw, H., Van Royen, P., & Denekens, J. (2001). Patient adherence to treatment: three decades of research. A comprehensive review. Journal of clinical pharmacy and therapeutics, 26(5), 331–342. https://doi.org/10.1046/j.1365-2710.2001.00363.x
Vasey, L. M. (1990). DNAs and DNCTs—why do patients fail to begin or to complete a course of physiotherapy treatment?. Physiotherapy, 76(9), 575-578.
Friedrich, M., Gittler, G., Halberstadt, Y., Cermak, T., & Heiller, I. (1998). Combined exercise and motivation program: effect on the compliance and level of disability of patients with chronic low back pain: a randomized controlled trial. Archives of physical medicine and rehabilitation, 79(5), 475–487. https://doi.org/10.1016/s0003-9993(98)90059-4
Campbell, R., Evans, M., Tucker, M., Quilty, B., Dieppe, P., & Donovan, J. L. (2001). Why don’t patients do their exercises? Understanding non-compliance with physiotherapy in patients with osteoarthritis of the knee. Journal of epidemiology and community health, 55(2), 132–138. https://doi.org/10.1136/jech.55.2.132
Sluijs, E. M., Kok, G. J., & van der Zee, J. (1993). Correlates of exercise compliance in physical therapy. Physical therapy, 73(11), 771–786. https://doi.org/10.1093/ptj/73.11.771
Chester, R., Jerosch-Herold, C., Lewis, J., & Shepstone, L. (2018). Psychological factors are associated with the outcome of physiotherapy for people with shoulder pain: a multicentre longitudinal cohort study. British journal of sports medicine, 52(4), 269–275.
Kalauokalani, D., Cherkin, D. C., Sherman, K. J., Koepsell, T. D., & Deyo, R. A. (2001). Lessons from a trial of acupuncture and massage for low back pain: patient expectations and treatment effects. Spine, 26(13), 1418–1424.
Nadine E. Foster (2007). Beliefs and preferences: do they help determine the outcome of musculoskeletal problems?,Physical Therapy Reviews,12:3,199-206
Preference Collaborative Review Group (2008). Patients‘ preferences within randomised trials: systematic review and patient level meta-analysis. BMJ (Clinical research ed.), 337, a1864.
Mondloch, M. V., Cole, D. C., & Frank, J. W. (2001). Does how you do depend on how you think you’ll do? A systematic review of the evidence for a relation between patients‘ recovery expectations and health outcomes. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne, 165(2), 174–179.
Sherman, K. J., Cherkin, D. C., Ich ikawa, L., Avins, A. L., Delaney, K., Barlow, W. E., Khalsa, P. S., & Deyo, R. A. (2010). Treatment expectations and preferences as predictors of outcome of acupuncture for chronic back pain. Spine, 35(15), 1471–1477. https://doi.org/10.1097/BRS.0b013e3181c2a8d3
Müller-Schrader, Matthiasa,*; Heinzle, Jakoba; Müller, Alfredb; Lanz, Christianb; Häussler, Oliverb; Sutter, Martinb; Eggspühler, Andreasb; Mare, Stefaniab; Toussaint, Birtea; Pereira, Inêsa; Petzschner, Frederike H.a,c,d; Wiech, Katjae; Barth, Jürgenf; Witt, Claudia M.f; Stephan, Klaas Ennoa; Manjaly, Zina-Maryb,g. Individual treatment expectations predict clinical outcome after lumbar injections against low back pain. PAIN: May 10, 2022 – Volume – Issue – 10.1097/j.pain.0000000000002674 doi: 10.1097/j.pain.0000000000002674
Schmidt, Katharinaa,*; Berding, Tobiasa; Kleine-Borgmann, Juliana; Engler, Haraldb; Holle-Lee, Dagnya; Gaul, Charlyc; Bingel, Ulrikea. The beneficial effect of positive treatment expectations on pharmacological migraine prophylaxis. PAIN: February 2022 – Volume 163 – Issue 2 – p e319-e327 doi: 10.1097/j.pain.0000000000002341
Wager, T. D., Rilling, J. K., Smith, E. E., Sokolik, A., Casey, K. L., Davidson, R. J., Kosslyn, S. M., Rose, R. M., & Cohen, J. D. (2004). Placebo-induced changes in FMRI in the anticipation and experience of pain. Science (New York, N.Y.), 303(5661), 1162–1167. https://doi.org/10.1126/science.1093065
Atlas, L. Y., & Wager, T. D. (2012). How expectations shape pain. Neuroscience letters, 520(2), 140–148. https://doi.org/10.1016/j.neulet.2012.03.039
Porro, C. A., Baraldi, P., Pagnoni, G., Serafini, M., Facchin, P., Maieron, M., & Nichelli, P. (2002). Does anticipation of pain affect cortical nociceptive systems?. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(8), 3206–3214. https://doi.org/10.1523/JNEUROSCI.22-08-03206.2002
Lorenz, J., Hauck, M., Paur, R. C., Nakamura, Y., Zimmermann, R., Bromm, B., & Engel, A. K. (2005). Cortical correlates of false expectations during pain intensity judgments–a possible manifestation of placebo/nocebo cognitions. Brain, behavior, and immunity, 19(4), 283–295. https://doi.org/10.1016/j.bbi.2005.03.010
Ploghaus, A., Becerra, L., Borras, C., & Borsook, D. (2003). Neural circuitry underlying pain modulation: expectation, hypnosis, placebo. Trends in cognitive sciences, 7(5), 197–200. https://doi.org/10.1016/s1364-6613(03)00061-5
Corbetta, M., & Shulman, G. L. (2002). Control of goal-directed and stimulus-driven attention in the brain. Nature reviews. Neuroscience, 3(3), 201–215. https://doi.org/10.1038/nrn755
Weiss, J., Pyrski, M., Jacobi, E., Bufe, B., Willnecker, V., Schick, B., … & Zufall, F. (2011). Loss-of-function mutations in sodium channel Nav1. 7 cause anosmia. Nature, 472(7342), 186-190.
Cox, J. J., Reimann, F., Nicholas, A. K., Thornton, G., Roberts, E., Springell, K., … & Woods, C. G. (2006). An SCN9A channelopathy causes congenital inability to experience pain. Nature, 444(7121), 894-898.
Minett, M. S., Nassar, M. A., Clark, A. K., Passmore, G., Dickenson, A. H., Wang, F., … & Wood, J. N. (2012). Distinct Nav1. 7-dependent pain sensations require different sets of sensory and sympathetic neurons. Nature communications, 3(1), 1-9.
Gingras, J., Smith, S., Matson, D. J., Johnson, D., Nye, K., Couture, L., … & McDonough, S. I. (2014). Global Nav1. 7 knockout mice recapitulate the phenotype of human congenital indifference to pain. PloS one, 9(9), e105895.
Buckthorpe, M., Tamisari, A., & Villa, F. D. (2020). A TEN TASK-BASED PROGRESSION IN REHABILITATION AFTER ACL RECONSTRUCTION: FROM POST-SURGERY TO RETURN TO PLAY – A CLINICAL COMMENTARY. International journal of sports physical therapy, 15(4), 611–623.
Breda, S. J., Oei, E., Zwerver, J., Visser, E., Waarsing, E., Krestin, G. P., & de Vos, R. J. (2021). Effectiveness of progressive tendon-loading exercise therapy in patients with patellar tendinopathy: a randomised clinical trial. British journal of sports medicine, 55(9), 501–509. https://doi.org/10.1136/bjsports-2020-103403
Whiteley, R., Wangensteen, A., van Dyk, N. & Jacobsen, P. (o. D.). Rehabilitation and return to sport after hamstring injury. www.aspetar.com.
Acute Adductor Injuries Treatment Protocol. (o. D.). www.aspetar.com.
Artus, M., van der Windt, D. A., Jordan, K. P., & Hay, E. M. (2010). Low back pain symptoms show a similar pattern of improvement following a wide range of primary care treatments: a systematic review of randomized clinical trials. Rheumatology (Oxford, England), 49(12), 2346–2356. https://doi.org/10.1093/rheumatology/keq245
Leproult, R., & Van Cauter, E. (2011). Effect of 1 week of sleep restriction on testosterone levels in young healthy men. JAMA, 305(21), 2173–2174. https://doi.org/10.1001/jama.2011.710
Bremner W. J. (2010). Testosterone deficiency and replacement in older men. The New England journal of medicine, 363(2), 189–191. https://doi.org/10.1056/NEJMe1006197
Cohen, S., Doyle, W. J., Alper, C. M., Janicki-Deverts, D., & Turner, R. B. (2009). Sleep habits and susceptibility to the common cold. Archives of internal medicine, 169(1), 62–67. https://doi.org/10.1001/archinternmed.2008.505
Milewski, M. D., Skaggs, D. L., Bishop, G. A., Pace, J. L., Ibrahim, D. A., Wren, T. A., & Barzdukas, A. (2014). Chronic lack of sleep is associated with increased sports injuries in adolescent athletes. Journal of pediatric orthopedics, 34(2), 129–133. https://doi.org/10.1097/BPO.0000000000000151
Schrimpf, M., Liegl, G., Boeckle, M., Leitner, A., Geisler, P., & Pieh, C. (2015). The effect of sleep deprivation on pain perception in healthy subjects: a meta-analysis. Sleep medicine, 16(11), 1313–1320. https://doi.org/10.1016/j.sleep.2015.07.022
Schuh-Hofer, S., Wodarski, R., Pfau, D. B., Caspani, O., Magerl, W., Kennedy, J. D., & Treede, R. D. (2013). One night of total sleep deprivation promotes a state of generalized hyperalgesia: a surrogate pain model to study the relationship of insomnia and pain. Pain, 154(9), 1613–1621. https://doi.org/10.1016/j.pain.2013.04.046
Chiu, Y. H., Silman, A. J., Macfarlane, G. J., Ray, D., Gupta, A., Dickens, C., Morriss, R., & McBeth, J. (2005). Poor sleep and depression are independently associated with a reduced pain threshold. Results of a population based study. Pain, 115(3), 316–321. https://doi.org/10.1016/j.pain.2005.03.009
Ağargün, M. Y., Tekeoğlu, I., Güneş, A., Adak, B., Kara, H., & Ercan, M. (1999). Sleep quality and pain threshold in patients with fibromyalgia. Comprehensive psychiatry, 40(3), 226–228. https://doi.org/10.1016/s0010-440x(99)90008-1
Meerlo, P., Sgoifo, A., & Suchecki, D. (2008). Restricted and disrupted sleep: effects on autonomic function, neuroendocrine stress systems and stress responsivity. Sleep medicine reviews, 12(3), 197–210. https://doi.org/10.1016/j.smrv.2007.07.007
Morselli, L., Leproult, R., Balbo, M., & Spiegel, K. (2010). Role of sleep duration in the regulation of glucose metabolism and appetite. Best practice & research. Clinical endocrinology & metabolism, 24(5), 687–702. https://doi.org/10.1016/j.beem.2010.07.005
Knutson, K. L., Spiegel, K., Penev, P., & Van Cauter, E. (2007). The metabolic consequences of sleep deprivation. Sleep medicine reviews, 11(3), 163–178. https://doi.org/10.1016/j.smrv.2007.01.002
Atrooz, F., & Salim, S. (2020). Sleep deprivation, oxidative stress and inflammation. Advances in protein chemistry and structural biology, 119, 309–336. https://doi.org/10.1016/bs.apcsb.2019.03.001
Fullagar, H. H., & Bartlett, J. D. (2016). Time to wake up: individualising the approach to sleep promotion interventions. British journal of sports medicine, 50(3), 143–144. https://doi.org/10.1136/bjsports-2015-095759
De Pauw, K., Roelands, B., Marusic, U., Tellez, H. F., Knaepen, K., & Meeusen, R. (2013). Brain mapping after prolonged cycling and during recovery in the heat. Journal of applied physiology (Bethesda, Md. : 1985), 115(9), 1324–1331. https://doi.org/10.1152/japplphysiol.00633.2013
Brain, K & Kollegen (2020). Ernährung und chronische Schmerzen. https://iaspfiles.s3.amazonaws.com/production/public/GY%202020%20Fact%20Sheet%206%20German.pdf
GBD 2017 Diet Collaborators (2019). Health effects of dietary risks in 195 countries, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet (London, England), 393(10184), 1958–1972. https://doi.org/10.1016/S0140-6736(19)30041-8
Naylor R, Hayes C, Egger G. The Relationship Between Lifestyle, Metaflammation, and Chronic Pain: A Systematic Review. American Journal of Lifestyle Medicine. 2013;7(2):130-137. doi:10.1177/1559827612451710
Okifuji, A., & Hare, B. D. (2015). The association between chronic pain and obesity. Journal of pain research, 8, 399–408. https://doi.org/10.2147/JPR.S55598
Tipton, K. D., Borsheim, E., Wolf, S. E., Sanford, A. P., & Wolfe, R. R. (2003). Acute response of net muscle protein balance reflects 24-h balance after exercise and amino acid ingestion. American journal of physiology. Endocrinology and metabolism, 284(1), E76–E89. https://doi.org/10.1152/ajpendo.00234.2002
Reich, K. A., Chen, Y. W., Thompson, P. D., Hoffman, E. P., & Clarkson, P. M. (2010). Forty-eight hours of unloading and 24 h of reloading lead to changes in global gene expression patterns related to ubiquitination and oxidative stress in humans. Journal of applied physiology (Bethesda, Md. : 1985), 109(5), 1404–1415. https://doi.org/10.1152/japplphysiol.00444.2010
Parr, E. B., Camera, D. M., Areta, J. L., Burke, L. M., Phillips, S. M., Hawley, J. A., & Coffey, V. G. (2014). Alcohol ingestion impairs maximal post-exercise rates of myofibrillar protein synthesis following a single bout of concurrent training. PloS one, 9(2), e88384. https://doi.org/10.1371/journal.pone.0088384
Jung, M. K., Callaci, J. J., Lauing, K. L., Otis, J. S., Radek, K. A., Jones, M. K., & Kovacs, E. J. (2011). Alcohol exposure and mechanisms of tissue injury and repair. Alcoholism, clinical and experimental research, 35(3), 392–399. https://doi.org/10.1111/j.1530-0277.2010.01356.x
Shaw, A. G., Chae, S., Levitt, D. E., Nicholson, J. L., Vingren, J. L., & Hill, D. W. (2022). Effect of Previous-Day Alcohol Ingestion on Muscle Function and Performance of Severe-Intensity Exercise, International Journal of Sports Physiology and Performance, 17(1), 44-49. Retrieved Jan 6, 2023, from https://journals.humankinetics.com/view/journals/ijspp/17/1/article-p44.xml
Zheng, D., Yuan, X., Ma, C., Liu, Y., VanEvery, H., Sun, Y., Wu, S., & Gao, X. (2021). Alcohol consumption and sleep quality: a community-based study. Public health nutrition, 24(15), 4851–4858. https://doi.org/10.1017/S1368980020004553
Colrain, I. M., Nicholas, C. L., & Baker, F. C. (2014). Alcohol and the sleeping brain. Handbook of clinical neurology, 125, 415–431. https://doi.org/10.1016/B978-0-444-62619-6.00024-0
Tipton K. D. (2015). Nutritional Support for Exercise-Induced Injuries. Sports medicine (Auckland, N.Z.), 45 Suppl 1, S93–S104. https://doi.org/10.1007/s40279-015-0398-4
Aragon, A. A., Schoenfeld, B. J., Wildman, R., Kleiner, S., VanDusseldorp, T., Taylor, L., Earnest, C. P., Arciero, P. J., Wilborn, C., Kalman, D. S., Stout, J. R., Willoughby, D. S., Campbell, B., Arent, S. M., Bannock, L., Smith-Ryan, A. E., & Antonio, J. (2017). International society of sports nutrition position stand: diets and body composition. Journal of the International Society of Sports Nutrition, 14, 16. https://doi.org/10.1186/s12970-017-0174-y
Layman D. K. (2009). Dietary Guidelines should reflect new understandings about adult protein needs. Nutrition & metabolism, 6, 12. https://doi.org/10.1186/1743-7075-6-12
Layman, D. K., Boileau, R. A., Erickson, D. J., Painter, J. E., Shiue, H., Sather, C., & Christou, D. D. (2003). A reduced ratio of dietary carbohydrate to protein improves body composition and blood lipid profiles during weight loss in adult women. The Journal of nutrition, 133(2), 411–417. https://doi.org/10.1093/jn/133.2.411
Weigle, D. S., Breen, P. A., Matthys, C. C., Callahan, H. S., Meeuws, K. E., Burden, V. R., & Purnell, J. Q. (2005). A high-protein diet induces sustained reductions in appetite, ad libitum caloric intake, and body weight despite compensatory changes in diurnal plasma leptin and ghrelin concentrations. The American journal of clinical nutrition, 82(1), 41–48. https://doi.org/10.1093/ajcn.82.1.41
Evans, D. C., Martindale, R. G., Kiraly, L. N., & Jones, C. M. (2014). Nutrition optimization prior to surgery. Nutrition in clinical practice : official publication of the American Society for Parenteral and Enteral Nutrition, 29(1), 10–21. https://doi.org/10.1177/0884533613517006
Demling R. H. (2009). Nutrition, anabolism, and the wound healing process: an overview. Eplasty, 9, e9.
Jäger, R., Kerksick, C. M., Campbell, B. I., Cribb, P. J., Wells, S. D., Skwiat, T. M., Purpura, M., Ziegenfuss, T. N., Ferrando, A. A., Arent, S. M., Smith-Ryan, A. E., Stout, J. R., Arciero, P. J., Ormsbee, M. J., Taylor, L. W., Wilborn, C. D., Kalman, D. S., Kreider, R. B., Willoughby, D. S., Hoffman, J. R., … Antonio, J. (2017). International Society of Sports Nutrition Position Stand: protein and exercise. Journal of the International Society of Sports Nutrition, 14, 20. https://doi.org/10.1186/s12970-017-0177-8 Hart, D. W., Wolf, S. E., Zhang, X. J., Chinkes, D. L., Buffalo, M. C., Matin, S. I., DebRoy, M. A., Wolfe, R. R., & Herndon, D. N. (2001). Efficacy of a high-carbohydrate diet in catabolic illness. Critical care medicine, 29(7), 1318–1324. https://doi.org/10.1097/00003246-200107000-00004
Thomas, D. T., Erdman, K. A., & Burke, L. M. (2016). American College of Sports Medicine Joint Position Statement. Nutrition and Athletic Performance. Medicine and science in sports and exercise, 48(3), 543–568. https://doi.org/10.1249/MSS.0000000000000852
Stechmiller J. K. (2010). Understanding the role of nutrition and wound healing. Nutrition in clinical practice : official publication of the American Society for Parenteral and Enteral Nutrition, 25(1), 61–68. https://doi.org/10.1177/0884533609358997
Lin, E., Kotani, J. G., & Lowry, S. F. (1998). Nutritional modulation of immunity and the inflammatory response. Nutrition (Burbank, Los Angeles County, Calif.), 14(6), 545–550. https://doi.org/10.1016/s0899-9007(98)00046-x
Calder P. C. (2013). n-3 fatty acids, inflammation and immunity: new mechanisms to explain old actions. The Proceedings of the Nutrition Society, 72(3), 326–336. https://doi.org/10.1017/S0029665113001031
Galland L. (2010). Diet and inflammation. Nutrition in clinical practice : official publication of the American Society for Parenteral and Enteral Nutrition, 25(6), 634–640. https://doi.org/10.1177/0884533610385703
Agostoni, C., Bresson, J. L., Fairweather Tait, S., Flynn, A., Golly, I., Korhonen, H., … & Verhagen, H. (2012). Scientific opinion on the tolerable upper intake level of eicosapentaenoic acid (EPA), docosahexaenoic acid (DHA) and docosapentaenoic acid (DPA): EFSA panel on dietetic products, nutrition and allergies (NDA).
Kiecolt-Glaser, J. K., Page, G. G., Marucha, P. T., MacCallum, R. C., & Glaser, R. (1998). Psychological influences on surgical recovery. Perspectives from psychoneuroimmunology. The American psychologist, 53(11), 1209–1218. https://doi.org/10.1037//0003-066x.53.11.1209
Rosenberger, P. H., Jokl, P., & Ickovics, J. (2006). Psychosocial factors and surgical outcomes: an evidence-based literature review. The Journal of the American Academy of Orthopaedic Surgeons, 14(7), 397–405. https://doi.org/10.5435/00124635-200607000-00002
Cole-King, A., & Harding, K. G. (2001). Psychological factors and delayed healing in chronic wounds. Psychosomatic medicine, 63(2), 216–220. https://doi.org/10.1097/00006842-200103000-00004
Ebrecht, M., Hextall, J., Kirtley, L. G., Taylor, A., Dyson, M., & Weinman, J. (2004). Perceived stress and cortisol levels predict speed of wound healing in healthy male adults. Psychoneuroendocrinology, 29(6), 798–809. https://doi.org/10.1016/S0306-4530(03)00144-6
McGuire, L., Heffner, K., Glaser, R., Needleman, B., Malarkey, W., Dickinson, S., Lemeshow, S., Cook, C., Muscarella, P., Melvin, W. S., Ellison, E. C., & Kiecolt-Glaser, J. K. (2006). Pain and wound healing in surgical patients. Annals of behavioral medicine : a publication of the Society of Behavioral Medicine, 31(2), 165–172. https://doi.org/10.1207/s15324796abm3102_8
Graham, J. E., Robles, T. F., Kiecolt-Glaser, J. K., Malarkey, W. B., Bissell, M. G., & Glaser, R. (2006). Hostility and pain are related to inflammation in older adults. Brain, behavior, and immunity, 20(4), 389–400. https://doi.org/10.1016/j.bbi.2005.11.002
Marucha, P. T., Kiecolt-Glaser, J. K., & Favagehi, M. (1998). Mucosal wound healing is impaired by examination stress. Psychosomatic medicine, 60(3), 362–365. https://doi.org/10.1097/00006842-199805000-00025
Bosch, J. A., Engeland, C. G., Cacioppo, J. T., & Marucha, P. T. (2007). Depressive symptoms predict mucosal wound healing. Psychosomatic medicine, 69(7), 597–605. https://doi.org/10.1097/PSY.0b013e318148c682
Marie Johnston, Ph.D., Claus Vögele, Ph.D., Benefits of Psychological Preparation for Surgery: a Meta-Analysis, Annals of Behavioral Medicine, Volume 15, Issue 4, 1993, Pages 245–256, https://doi.org/10.1093/abm/15.4.245
Montgomery, G. H., David, D., Winkel, G., Silverstein, J. H., & Bovbjerg, D. H. (2002). The effectiveness of adjunctive hypnosis with surgical patients: a meta-analysis. Anesthesia and analgesia, 94(6), . https://doi.org/10.1097/00000539-200206000-00052
Charles F. Emery, Ph.D., James A. Blumenthal, Ph.D., Effects of Physical Exercise on Psychological and Cognitive Functioning of Older Adults, Annals of Behavioral Medicine, Volume 13, Issue 3, 1991, Pages 99–107, https://doi.org/10.1093/abm/13.3.99
Emery, C. F., Kiecolt-Glaser, J. K., Glaser, R., Malarkey, W. B., & Frid, D. J. (2005). Exercise accelerates wound healing among healthy older adults: a preliminary investigation. The journals of gerontology. Series A, Biological sciences and medical sciences, 60(11), 1432–1436. https://doi.org/10.1093/gerona/60.11.1432
Gouin, J. P., & Kiecolt-Glaser, J. K. (2011). The impact of psychological stress on wound healing: methods and mechanisms. Immunology and allergy clinics of North America, 31(1), 81–93. https://doi.org/10.1016/j.iac.2010.09.010
Padgett, D. A., & Glaser, R. (2003). How stress influences the immune response. Trends in immunology, 24(8), 444–448. https://doi.org/10.1016/s1471-4906(03)00173-x
Glaser, R., & Kiecolt-Glaser, J. K. (2005). Stress-induced immune dysfunction: implications for health. Nature reviews. Immunology, 5(3), 243–251. https://doi.org/10.1038/nri1571
Steptoe, A., Wardle, J., Pollard, T. M., Canaan, L., & Davies, G. J. (1996). Stress, social support and health-related behavior: a study of smoking, alcohol consumption and physical exercise. Journal of psychosomatic research, 41(2), 171–180. https://doi.org/10.1016/0022-3999(96)00095-5
Vitaliano, P. P., Scanlan, J. M., Zhang, J., Savage, M. V., Hirsch, I. B., & Siegler, I. C. (2002). A path model of chronic stress, the metabolic syndrome, and coronary heart disease. Psychosomatic medicine, 64(3), 418–435. https://doi.org/10.1097/00006842-200205000-00006
Benveniste, K., & Thut, P. (1981). The effect of chronic alcoholism on wound healing. Proceedings of the Society for Experimental Biology and Medicine. Society for Experimental Biology and Medicine (New York, N.Y.), 166(4), 568–575. https://doi.org/10.3181/00379727-166-41110
Silverstein P. (1992). Smoking and wound healing. The American journal of medicine, 93(1A), 22S–24S. https://doi.org/10.1016/0002-9343(92)90623-j
Altemus, M., Rao, B., Dhabhar, F. S., Ding, W., & Granstein, R. D. (2001). Stress-induced changes in skin barrier function in healthy women. The Journal of investigative dermatology, 117(2), 309–317. https://doi.org/10.1046/j.1523-1747.2001.01373.x
Veldhuis, J. D., & Iranmanesh, A. (1996). Physiological regulation of the human growth hormone (GH)-insulin-like growth factor type I (IGF-I) axis: predominant impact of age, obesity, gonadal function, and sleep. Sleep, 19(10 Suppl), S221–S224. https://doi.org/10.1093/sleep/19.suppl_10.s221
Keylock, K. T., Vieira, V. J., Wallig, M. A., DiPietro, L. A., Schrementi, M., & Woods, J. A. (2008). Exercise accelerates cutaneous wound healing and decreases wound inflammation in aged mice. American journal of physiology. Regulatory, integrative and comparative physiology, 294(1), R179–R184. https://doi.org/10.1152/ajpregu.00177.2007
Russell L. (2001). The importance of patients‘ nutritional status in wound healing. British journal of nursing (Mark Allen Publishing), 10(6 Suppl), S42–S49. https://doi.org/10.12968/bjon.2001.10.Sup1.5336
McDaniel, J. C., Belury, M., Ahijevych, K., & Blakely, W. (2008). Omega-3 fatty acids effect on wound healing. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society, 16(3), 337–345. https://doi.org/10.1111/j.1524-475X.2008.00388.x
Posthauer M. E. (2006). The role of nutrition in wound care. Advances in skin & wound care, 19(1), 43–54. https://doi.org/10.1097/00129334-200601000-00015
Sackett, D. L., Rosenberg, W. M., Gray, J. A., Haynes, R. B., & Richardson, W. S. (1996). Evidence based medicine: what it is and what it isn’t. BMJ (Clinical research ed.), 312(7023), 71–72. https://doi.org/10.1136/bmj.312.7023.71